Nếu nguồn nước thải đầu vào có nồng độ Amoniac cao hơn hoặc có độ kiềm tự nhiên thấp, sẽ xảy ra việc giảm pH nhanh, gây ảnh hưởng đến quá trình chuyển hóa. Vì thế, cần phải tính độ kiềm cần thiết để quá trình Nitrat hóa diễn ra được tối ưu và xử lý hoàn toàn chỉ tiêu Amonia.

Vì sao cần tính độ kiềm cho quá trình Nitrat hóa?
Độ kiềm rất quan trọng trong quá trình xử lý Ammonia trong nước thải. Nó thực hiện các vai trò:
- Là chất đệm pH giúp duy trì gần giá trị pH trung tính và hoạt động enzym thích hợp.
- Là nguồn Carbon cho vi khuẩn Nitrat và thúc đẩy quá trình Nitrat hóa.
Quá trình Nitrat hóa diễn ra tại bể sinh học hiếu khí. Trong quá trình này, vi khuẩn Nitrat hóa cũng tạo ra axit. Do vậy, sẽ làm cho pH trong bể hiếu khí giảm xuống. pH càng giảm sẽ ức chế quá trình Nitrat hóa. Độ kiềm trong nước thải có sẵn và hoạt động như một chất đệm cho các axit do vi khuẩn Nitrat hóa tạo ra. Nếu có đủ độ kiềm, độ pH vẫn nằm trong phạm vi mong muốn đối với vi khuẩn Nitrat hóa và quá trình chuyển đổi vẫn xảy ra.
Tuy nhiên, nếu nguồn nước thải đầu vào có nồng độ Amoniac cao hơn hoặc có độ kiềm tự nhiên thấp, sẽ xảy ra việc giảm pH nhanh, gây ảnh hưởng đến quá trình chuyển hóa. Vì thế, cần phải tính độ kiềm cần thiết để quá trình Nitrat hóa diễn ra được tối ưu và xử lý hoàn toàn chỉ tiêu Amonia.
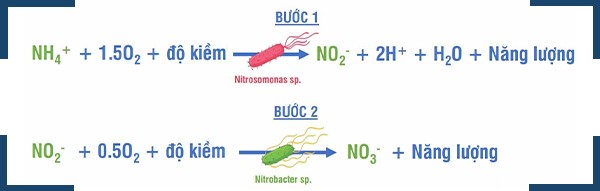
Hình 1. Độ kiềm tham gia vào quá trình Nitrat hóa.
Cách tính độ kiềm cần thiết cho quá trình Nitrat hóa
– Cách tính lượng độ kiềm cần bổ sung
Độ kiềm trong nước thải được thể hiện bởi:
- Độ kiềm Phenolphthalein (độ kiềm tự do).
- Độ kiềm tổng số (độ kiềm toàn phần: Carbonate, Bicarbonate và Hydroxit).
Nồng độ của thành phần độ kiềm tổng số sẽ được xác định khi biết được độ kiềm Phenolphthalein. Để tính được thành phần của độ kiềm trong nước thải cần dựa vào bảng quan hệ độ kiềm như sau:
| Kết quả chuẩn độ | Trường hợp | Độ kiềm hydroxide bằng: | Độ kiềm Carbonate bằng: | Độ kiềm Bicarbonate bằng: |
| 1 | Độ kiềm Phenolphtalein = 0 | 0 | 0 | Độ kiềm tổng |
| 2 | Độ kiềm Phenolphtalein = Độ kiềm tổng | Độ kiềm tổng | 0 | 0 |
| 3 | Độ kiềm Phenolphtalein < 1/2 Độ kiềm tổng | 0 | 2 lần Độ kiềm Phenolphtalein | Độ kiềm tổng – 2 lần Độ kiềm Phenolphtalein |
| 4 | Độ kiềm Phenolphtalein = 1/2 Độ kiềm tổng | 0 | Độ kiềm tổng | 0 |
| 5 | Độ kiềm Phenolphtalein = 1/2 Độ kiềm tổng | 2 lần Độ kiềm Phenolphtalein – Độ kiềm tổng | 2 lần độ chênh giữa Độ kiềm tổng và Độ kiềm Phenolphtalein | 0 |
Ví dụ: Một mẫu nước thải có độ kiềm Phenolphtalein 170 mg/L theo CaCO3 và độ kiềm tổng 250 mg/L theo CaCO3. Nồng độ độ kiềm Hydroxide, Carbonate và Bicarbonate là bao nhiêu?
Có thể thấy rằng trong trường hợp này:
- Độ kiềm Phenolphtalein không phải bằng 0 mà bằng 170 mg/L.
- Độ kiểm Phenolphtalein không bằng độ kiềm tổng.
- Một nửa của độ kiềm tổng bằng 125 mg/L.
=> Độ kiềm Phenolphtalein là 170 mg/L > Độ kiềm tổng là 125 mg/L => Chọn hàng 5.
Từ đó, ta tính được:
• Độ kiềm Hyroxide bằng: 2 x 170 – 250 = 90 mg/L.
• Độ kiềm Carbonate bằng: 2 x (250 – 170) = 160 mg/L.
• Độ kiềm Bicarbonate bằng: 0 mg/L.
Kiểm tra kết quả tính độ kiềm: 90 mg/l độ kiềm Hydorxide + 160 mg/L độ kiềm Carbonate + 0 mg/L độ kiềm Bicarbonate = 250 mg/L.
Hình 2. Một số dụng cụ đo độ kiềm.
– Cách tính lượng Na2CO3 hoặc NaHCO3 cần châm vào sau khi đã xác định được độ kiềm cần
Trong những trường hợp khi tính độ kiềm cho ra kết quả thấp hơn lượng độ kiềm cần thiết để quá trình Nitrat hóa xảy ra tối ưu, cần bổ sung thêm Na2CO3 hoặc NaHCO3 vào hệ thống xử lý nước thải để tăng kiềm cho hệ thống. Cách tính toán lượng Na2CO3 hoặc NaHCO3 cần bổ sung như sau:
- Lượng độ kiềm cần thiết trong xử lý nước thải là: 1mg Amonia cần 7.1mg độ kiềm.
- Độ kiềm tiêu thụ: 1 mg N-NH4+ cần 7 mg CO32- hoặc 8.62 mg HCO3-.
- Hàm lượng gốc Cacbonat trong hóa chất sử dụng (Ví dụ: HCO3- chiếm 73% trong NaHCO3, CO32- chiếm 57% trong Na2CO3).
Ví dụ:
Giả thiết:
- Hệ thống xử lý nước thải có lưu lượng Q = 200 mg/l.
- Nồng độ Amonia đầu vào = 80 mg/l.
- Nồng độ Amonia đầu ra = 5 mg/l.
- Nồng độ Amonia cần xử lý = 75 mg/l.
- Độ kiềm Cacbonat đầu vào = 250 mg/l.
=> Độ kiềm Cacbonat thu hồi từ khử Nitrat = 75 x 3.6 = 270 mg/l (Nếu có xảy ra quá trình khử Nitrat, 1 mg NO3- sau phản ứng khử sẽ thu hồi 3.6 mg kiềm)
Phương pháp: Lựa chọn hóa chất NaHCO3
Độ kiềm Cacbonat cần tiêu thụ để xử lý 75 mg/l Amonia = 75 x 8.62 = 646.5 mg/l.
Độ kiềm Cacbonat thiếu = 646.5 – 250 – 270 = 126.5 mg/l.
=> Lượng kiềm Carbonat thiếu = 200 x 126.5 = 25300g = 25.3kg
=> Lượng hóa chất NaHCO3 cần = 25.3 / 73% = 34.6kg
Kết luận: Mỗi ngày cần dùng 34.6kg NaHCO3 để xử lý 75 mg/l Amonia.
—–
Việc duy trì và kiểm soát độ kiềm trong hệ thống xử lý nước thải rất quan trọng. Đặc biệt là trong quá trình xử lý Ammonia và Nitơ. Để hiểu hơn về cách tính độ kiềm và kiểm soát độ kiềm phù hợp cho từng hệ thống xử lý nước thải hãy, liên hệ đến HOTLINE 0909 538 514 để được tư vấn cụ thể.
>>> Xem thêm: Sử dụng tháp Stripping trong xử lý các chỉ tiêu về Nitơ



